Traduction libre
31 janv. 2024
Expliquer comment un essai clinique peut faire état d’un succès — alors qu’il n’y en a pas
|
Point clé : si le critère d’évaluation le plus important n’est pas mentionné dans le titre d’un essai clinique ou dans le résumé, c’est qu’il n’a pas changé. Il faut toujours chercher ce qui devrait être là — le chien qui n’a pas aboyé dans la nuit. |
Dans le dernier article, j’ai mis en évidence l’essai clinique FOURIER sur le Repatha, qui prétendait qu’il y avait une :
« réduction de 20 % du risque de l’un des principaux critères d’évaluation secondaires cliniquement plus grave, soit le décès cardiovasculaire (CV), l’infarctus du myocarde ou l’accident vasculaire cérébral ».
Lorsque les chiffres de la mort par CV étaient ceux-là :
Chez les patients traités par Repatha, 251 décès d’origine cardiovasculaire ont été enregistrés.
Chez les patients sous placebo, 240 décès d’origine cardiovasculaire ont été enregistrés.
Les deux affirmations sont vraies, si le mot « vrai » est approprié. Que diriez-vous de correct ? Ou sont étayées par des preuves. Mais comment se fait-il que deux « faits » apparemment contradictoires coexistent ? Eh bien, il faut commencer par examiner les points finaux.
Qu’est-ce qu’un point final (ou critère) ?
Le point final d’un essai clinique peut également être appelé « résultat ». Vous disposez d’un médicament dont vous pensez qu’il réduit le nombre de décès dus à une pathologie. Vous trouvez un groupe de personnes souffrant de cette maladie, par exemple d’un taux de cholestérol élevé, puis vous répartissez au hasard les participants à l’essai en deux groupes de même niveau. Vous donnez à une moitié du groupe le médicament actif et à l’autre moitié un placebo. (Nous reviendrons sur les problèmes posés par les placebos dans des articles ultérieurs).
Vous attendez ensuite de voir combien de personnes meurent dans les deux groupes. Si le nombre de décès dans le groupe placebo (par rapport au groupe traité) est supérieur à ce à quoi vous vous attendriez par le hasard (moins d’une chance sur vingt — p<0,05 %), vous obtenez un résultat statistiquement significatif. À ce stade, vous revendiquez un succès spectaculaire, puis vous gagnez des milliards en vendant votre médicament.
Le point final d’un essai de ce type est souvent énoncé comme suit : la prise du médicament y a entraîné une « réduction de x pour cent des décès ». Dix pour cent, vingt pour cent, trente pour cent, etc. Cela peut également être présenté comme la « réduction de la mortalité globale ».
Pourquoi le besoin d’un grand nombre de points finaux (ou critères) différents ?
De nombreux essais n’utilisent pas le décès comme critère d’évaluation principal. Si vous développez un nouvel analgésique, le critère d’évaluation que vous souhaitez mesurer sera… la réduction de la douleur. Si vous avez un antidépresseur, vous mesurez la réduction de la dépression.
Cependant, pour en revenir à la mort, ou à la non-mort, bien qu’il s’agisse de l’objectif numéro un de nombreux essais cardiovasculaires, c’est aussi le plus difficile à atteindre. En effet, si environ 40 % des personnes meurent d’une maladie cardiovasculaire, les 60 % restants n’en meurent pas.
Par conséquent, un médicament conçu pour éviter que les gens meurent d’une maladie cardiovasculaire ne peut réduire la mortalité que chez 40 % de la population totale (à moins qu’il n’ait d’autres effets bénéfiques inattendus).
Cela signifie qu’il n’est pas facile d’obtenir une réduction statistiquement significative de la mortalité globale, tout en ne réduisant les décès que dans un maximum de quarante pour cent de cette population.
Cela reste vrai même si l’on sélectionne pour l’essai des participants plus susceptibles de mourir d’une maladie cardiovasculaire, par exemple des personnes ayant déjà subi une crise cardiaque ou un accident vasculaire cérébral dans le passé. Dans ce cas, environ 80 % de cette population serait susceptible de mourir d’une maladie cardiovasculaire. [Chiffres utilisés ici à titre d’illustration uniquement].
Compte tenu de cette difficulté, vous pouvez décider de restreindre le critère d’évaluation de votre essai clinique à la mortalité cardiovasculaire et non à la mortalité globale. Ce sera plus facile à réaliser. Mais… attention, Will Robinson, attention ! Vous êtes maintenant arrivé à un point où il est possible de réduire la mortalité cardiovasculaire, tout en n’ayant aucun effet sur la mortalité globale.
Par exemple, votre médicament réduit le taux d’infarctus mortels de vingt pour cent, mais provoque simultanément un nombre égal et opposé de décès dus à une insuffisance hépatique. Bien qu’il y ait un bénéfice évident sur les décès dus à la maladie cardiovasculaire, la mortalité globale ne bougerait pas, ce qui ne représente généralement pas un résultat d’essai réussi. Les gens ne prennent pas de médicaments dans le seul but de remplacer une cause de décès par une autre. Du moins, pas à ma connaissance.
C’est pourquoi, chaque fois que j’examine des articles sur les médicaments cardiovasculaires, je commence par rechercher l’impact sur la mortalité globale. S’il n’est pas mentionné dans le titre, le résumé ou la discussion, je sais qu’il n’y a pas eu de changement. Il est généralement possible de le trouver quelque part dans l’article, bien qu’il puisse être caché dans une annexe ou un tableau accessible seulement après plusieurs niveaux de navigation. Page non trouvée.
Si nous revenons un instant sur l’étude Repatha, les chiffres réels de la mortalité globale étaient les suivants :
Chez les personnes prenant le Repatha, il y a eu : 444 décès.
Chez les patients sous placebo, il y a eu 426 décès.
Descendons d’un ou deux niveaux
Comme on pouvait s’y attendre, le communiqué de presse de l’étude FOURIER ne mentionnait pas la mortalité globale, qui a augmenté plutôt que diminué. Au lieu de cela, nous avons eu droit à ce qui suit. « Amgen annonce que Repatha® (Evolocumab) a significativement réduit le risque d’événements cardiovasculaires selon les résultats de l’étude FOURIER ».
La mortalité due à la CV n’a pas été mentionnée non plus, exactement pour la même raison : elle a augmenté et non diminué. Le mot « événements » a été utilisé à la place.
Qu’est-ce qu’un événement ? Comme mentionné dans l’article précédent, un événement cardiovasculaire peut être presque tout ce qui relève du domaine des maladies cardiovasculaires. Dans le cas de l’étude FOURIER, il y avait cinq types principaux d’« événements », ou points finaux, que l’on a décidé de mesurer :
-
Décès cardiovasculaire
-
Infarctus du myocarde
-
Accident vasculaire cérébral
-
Hospitalisation pour angor instable
-
Revascularisation coronaire
C’est ici que se joue le jeu de l’obscurcissement. Ce qu’Amgen a décrété, avant le début de l’essai, c’est qu’ils allaient prendre ces critères et les lier tous ensemble pour former un critère « combiné ». Il ne s’agit pas d’un seul critère, mais de cinq. Il s’agissait du résultat principal de l’essai.
Pourquoi ? Eh bien, il y a de nombreuses raisons, bien qu’aucune d’entre elles n’ait grand-chose à voir avec le fait de repousser les limites de la connaissance médicale. Il s’agit principalement d’économiser du temps et de l’argent, et d’augmenter les profits.
Dans ce cas, trois des événements sont raisonnables. Décès CV, infarctus et accident vasculaire cérébral. [Remarquez bien, pas d’infarctus du myocarde fatal ou d’accident vasculaire cérébral fatal — et ceci est également important].
Quant aux deux autres. L’hospitalisation pour angine instable et la revascularisation coronaire (pose d’un stent). Ce ne sont pas de véritables événements CV. Ce sont des décisions cliniques. Admettre ou non un patient souffrant d’angine de poitrine. Poser ou non un stent. En tant que telles, elles sont immédiatement sujettes à des biais.
Maintenant, je sais ce que certains d’entre vous pensent. Les essais de médicaments ne sont-ils pas censés être réalisés en double aveugle ? Le double aveugle signifie que ni le participant à l’essai ni le médecin traitant ne savent si le participant prend le médicament ou le placebo. Les biais sont donc éliminés.
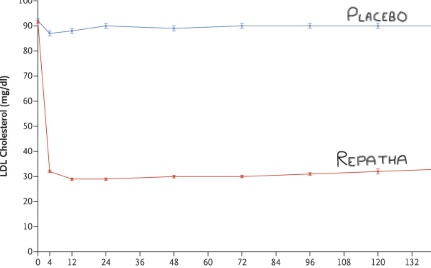
Deux problèmes se posent ici. Le premier est que le Repatha abaisse le LDL de plus de 60 %. Jusqu’à des niveaux rarement observés chez les êtres humains vivants. (Voir le graphique).
Ainsi, toute personne qui prend connaissance d’un résultat de test sanguin, médecin ou patient, sait exactement qui prend le médicament et qui ne le prend pas. En outre, si vous êtes admis à l’hôpital alors que vous participez à un essai clinique, l’équipe médicale doit savoir que vous participez à l’essai et que vous prenez le médicament ou le placebo. Ceci pour des raisons de sécurité. Par conséquent, si vous avez besoin d’une assistance médicale alors que vous participez à une étude, l’aveuglement s’évanouit.
Et une fois l’aveuglement levé, la décision de poser ou non une endoprothèse (stent) sera inévitablement influencée par le taux de LDL. Un taux de LDL très bas… eh bien, ces personnes peuvent probablement se passer d’une endoprothèse, parce qu’elles présentent un faible risque.
Il y a ensuite les décisions relatives à la question de savoir si une personne a été victime d’un AVC ou non. Vous pouvez penser que cette question est très claire. Dans certains cas, elle l’est. Perte de puissance d’un côté, bouche tombante, perte de vision, c’est très grave. Cependant, de nombreux accidents vasculaires cérébraux sont loin d’être aussi tranchés. Un « événement » bénin peut être un accident vasculaire cérébral, ou non. Il n’existe pas de test définitif.
Quant à l’infarctus du myocarde, là encore, les choses sont loin d’être claires. Voici un extrait de l’article « Misclassification of Myocardial Injury as Myocardial Infarction » (Erreur de classification d’une lésion du myocarde en infarctus du myocarde).
« Avec l’introduction généralisée des tests de troponine à haute sensibilité, la détection des lésions myocardiques chez les patients hospitalisés est devenue plus fréquente ; actuellement, la cause la plus courante de l’élévation de la troponine pourrait être une lésion myocardique non ischémique plutôt qu’un infarctus aigu du myocarde (IM). La détection de concentrations anormales de troponine en l’absence d’ischémie a semé la confusion ; cette situation a souvent été qualifiée de “troponinémie”, de “troponinite” ou, à tort, d’infarctus du myocarde de type 2 (T2IM ; pour lequel l’ischémie coronaire est une condition préalable) Misclassification of Myocardial Injury as Myocardial Infarction ».
Peut-être un peu trop de jargon ? Dans ce cas, concentrez-vous sur les mots « erreur de classification » et « confusion ». En d’autres termes, il est parfaitement possible d’affirmer qu’une personne a subi un infarctus du myocarde alors que ce n’est pas le cas. Et lorsqu’il n’y a plus d’aveuglement, le biais entre en jeu.
Alors, respirez profondément, ce n’est pas fini, n’est-ce pas ? C’est la vérité qui met ses bottes. Un long processus avec de nombreux nœuds à démêler, puis à refaire…
… dans l’essai FOURIER, nous avons cinq critères d’évaluation combinés en un seul. Quatre d’entre eux sont sujets à des biais et deux d’entre eux ne sont pas vraiment des événements cliniques. Le décès d’origine cardiovasculaire est le critère d’évaluation le plus important, et de loin. C’est aussi celui qui est le moins sujet aux biais. C’est aussi celui qui n’a pas changé. [Même si, comme je l’expliquerai dans le prochain article, il n’a pas été épargné, tant s’en faut].
Ajouter tous les critères d’évaluation ensemble
L’utilisation par le promoteur de l’essai (l’entreprise pharmaceutique) d’un grand nombre de critères d’évaluation différents et leur addition présentent deux avantages majeurs. Le premier avantage est qu’il y a beaucoup plus de critères d’évaluation à mesurer, ce qui facilite et accélère la mise en évidence de la signification statistique. [Cet essai a été interrompu prématurément parce que le nombre de critères d’évaluation préétablis a été atteint plus tôt que prévu. Prévu pour durer 3,6 ans, il n’en a duré que 2,2].
Le deuxième avantage est que vous pouvez additionner toute une série de résultats, allant du décès d’origine cardiovasculaire à la revascularisation coronarienne, et suggérer, ou affirmer, ou prétendre, qu’ils sont d’égale importance. Cinquante stents plus un décès d’origine cardiovasculaire, c’est cinquante et un événements. Cinquante décès cardiovasculaires plus un stent, c’est aussi cinquante et un événements…. vraiment ?
De même, un infarctus du myocarde mortel compte exactement de la même manière qu’un infarctus du myocarde non mortel. Qu’en pensez-vous ? Oui, aucune pondération n’était nécessaire ici. Un événement est simplement un événement.
Alors, combien d’infarctus pensez-vous qu’il y ait eu dans le groupe placebo de l’étude FOURIER ?
La réponse est six cent trente-neuf — 639
Combien de crises cardiaques mortelles ?
La réponse est trente — 30
Quel est le nombre le plus grand ? Quel est le nombre qui devrait avoir le plus de poids ?
Le chiffre le plus important de tous, bien sûr, est le nombre de procédures de revascularisation. Dans le groupe placebo, il y en a eu neuf cent soixante-cinq — 965. Cela signifie qu’il y a eu quatre fois plus de stents posés que de décès cardiovasculaires.
À ce stade, vous devriez être en mesure de voir exactement où cela nous mène. Si l’on additionne les décès d’origine cardiovasculaire, les infarctus, les accidents vasculaires cérébraux, les hospitalisations pour angine de poitrine et les stents, nous obtenons 1 563 « événements » dans le groupe placebo. Faites de même pour le groupe Repatha et vous obtenez 1 344 « événements ». (Risque relatif 0,85 CI [0,78 – 0,92] P < 0,001), soit une réduction de 15 % du critère d’évaluation composite, décrite comme une :
« réduction de 15 % du risque du critère composite principal de décès cardiovasculaire, infarctus du myocarde, accident vasculaire cérébral, hospitalisation pour angor instable ou revascularisation coronaire ».
Si vous faites de même pour le critère d’évaluation combiné plus restreint des décès d’origine cardiovasculaire, des infarctus du myocarde et des accidents vasculaires cérébraux, on obtient 1 013 contre 816 pour le Placebo contre le Repatha. (Risque relatif 0,80 CI [0,73 – 0,88] P < 0,001). Ceci a été décrit comme une…
« réduction de 20 % du risque de l’un des principaux critères d’évaluation secondaires cliniquement plus grave, soit le décès cardiovasculaire (CV), l’infarctus du myocarde ou l’accident vasculaire cérébral ».
En mesurant plusieurs événements différents, en les additionnant et en prétendant qu’ils ont tous la même importance, vous pouvez réduire le point final (ou le critère) combiné, sans avoir aucun effet sur l’« événement » le plus important de cette combinaison. À savoir, les décès d’origine cardiovasculaire.
Ce faisant, vous obtenez des ventes de médicaments de 1,5 milliard de dollars par an. En termes de marketing pharmaceutique, il s’agit officiellement d’un « blockbuster ».
Au cas où vous vous poseriez la question. Je n’ai pas choisi cet article parce qu’il est remarquable ou qu’il constitue une sorte d’aberration. Ce n’est pas le seul article à avoir manipulé les chiffres de manière aussi spectaculaire. Ce type de compte rendu, et l’utilisation de critères d’évaluation combinés sont devenus monnaie courante. Peu le remarquent, encore moins s’en soucient.
Je suis également désolé d’annoncer que je n’ai pas encore terminé avec cet article. Il reste encore des points très importants à examiner. Alors, à la prochaine fois, au revoir.
Références :
1. Misclassification of Myocardial Injury as Myocardial Infarction (Mauvaise classification des lésions du myocarde en infarctus du myocarde) : Implications for Assessing Outcomes in Value-Based Programs; JAMA Cardiology, 17 mars 2019.
Texte original : https://brokenscience.org/research-manipulation-part-iv-falsely-reporting-success/